手性固定相介绍系列(五)——配体交换
手性配体交换技术是1961年首次发展得到应用的,这一技术结合了离子交换和配体化学两个领域的特征,从而可以实现上述任一过程常常不能单独完成的分离工作。
配体交换手性固定相主要以光活性氨基酸或哌可酸作为手性选择因子,通过涂渍或键合的方式制备而成的高聚物手性固定相。这种固定相主要用于氨基酸及其衍生物的分析。其已广泛地应用于毛细管电泳、薄层色谱以及高效液相色谱中。
手性配体交换原理
手性配体交换色谱拆分机制是基于固定相手性配体、金属离子与被分离溶质对映体形成一对非对映的配合物,二者的热力学稳定性差异导致了色谱分离。当非对映异构体络合物稳定性不同时,溶质对映体就有可能被分离。有人通过计算,认为这种稳定性之差在某些情况下可高达800kal/mol,这是由多齿状络合物中的位阻关系产生的。
图1是在配体交换实验中典型的非对映异构体络合物,(R,S)-络合物由于形成轴向的溶剂配体而比(S,S)-络合物稳定。
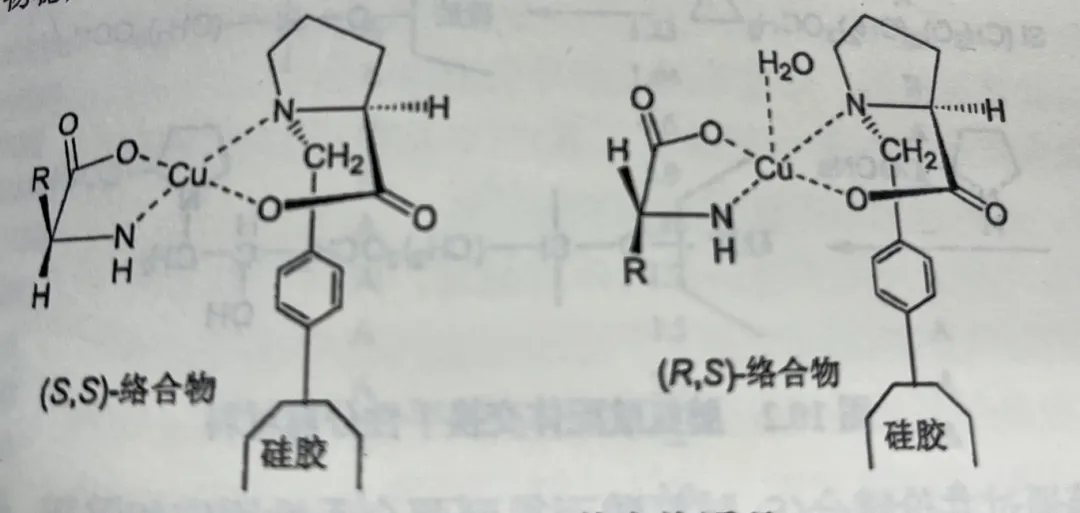
图1 手性配体交换原理
金属离子可以在轴向接受一个溶剂分子配体,形成较稳定的配位络合物。由于空间位阻关系,只有右式(R,S)-络合物允许形成轴向溶剂配体,而左式(S,S)-络合物由于溶质氨基酸R基团的空间位阻,不能形成这种轴向配位。
影响手性分离的因素
配体交换色谱的手性分离过程受流速、进样量、中心金属离子种类及其浓度、流动相的pH值、柱温、有机改性剂等因素影响。由于被拆分物质与手性配体进行配体交换的能力不同,对于那些配位能力差的被分离物质,在高流速下被拆分物质与手性配体无法充分实现配位交换,对拆分不利;而对于配位能力较强的被分离物质,流速对其分离影响不大。进样量过载对分离不利。
中心金属离子拆分能力的顺序为Cu(Ⅱ)>Ni(Ⅱ)>Zn(Ⅱ)>Cd(Ⅱ),因而Cu(Ⅱ)常用作中心离子。一般情况下,随着流动相pH值的增加,被拆分物质的容量因子(K’),α和R都会增加,当增加至碱性时,K‘和α增加更加显著,但往往会引起保留时间过长,峰形变差,同时过高的pH值对柱寿命有不利影响。

图片来源于网络,侵删
研究结果表明:对于不同种类氨基酸的手性拆分,应该选择不同键合量的手性固定相,因为不同种类的氨基酸与手性配体形成的配合物的稳定性各不相同。对于那些能够与手性配体形成稳定性较强的对映体应该选择键合量较小的短色谱柱,反之则选择键合量大的长色谱柱。
柱温对拆分结果的影响比较显著一般在亲水性强的聚乙烯胺体系上,保留值随柱温升高而增大,而在疏水性的聚苯乙烯体系上,保留值随柱温的升高而减小。有机改性剂的加入一般会缩短保留时间,导致分离效果降低。
常用的手性配体固定相
手性配体交换色谱固定相的制备方法有涂渍法和键合法,其中以后者为主。常见的键合的配体有L-脯氨酸、羟脯氨酸、组氨酸、缬氨酸、异喹啉羧酸、苯丙氨酸、酒石酸、氮杂环丁烷酸、哌啶酸、丙二胺、麻黄碱等。这些配体键合在高聚物骨架上形成固定相;常见的高聚物骨架有聚苯乙烯、聚乙烯胺、聚丙烯酸酯、聚丙烯酰胺等。目前,商业化的手性配体固定相也有许多不同类型的手性柱,有常用于α-氨基酸及其衍生物、α-羟基酸、氨基醇类化合物的拆分。
结语
配体交换手性固定相具有多种优点,如较强的手性识别能力、高分离效率等以及环保性和经济性较好等。这使得它在拆分多种对映体方面表现出良好的性能,为手性药物的研发和质量控制提供了有力的支持。然而,它也存在一些局限性,如对被分离对映体的结构有一定的要求,以及可能受到其他作用力干扰等问题。
未来,随着科技的不断进步和人们对手性化合物认识的深入,配体交换手性固定相的应用前景将更加广阔。


 地址:广州市黄埔区揽月路3号国际企业孵化器F座310
地址:广州市黄埔区揽月路3号国际企业孵化器F座310 电话:18922204815
电话:18922204815  传真:020-84418344
传真:020-84418344 邮箱:mzzhang@chiral-se.com
邮箱:mzzhang@chiral-se.com

