前沿 | PNAS:手性增强氧还原

研究背景
控制氧的还原对于开发清洁能源技术(如燃料电池)以及对好氧生物的生存至关重要。目前的燃料电池技术依赖于具有显著自旋-轨道耦合的稀有金属催化剂,而好氧生物在没有这些贵金属的情况下却可以实现高效氧还原,且许多生物分子,如蛋白质和DNA,都是手性的。最近的研究表明,手性结构会优先以一个自旋方向传输电子,这种现象被称为手性诱导自旋选择性(Chiral-induced spin selectivity, CISS)效应。该研究的意义在于它揭示了利用手性电极控制传递给氧的电子的自旋可以增强氧的还原。这一发现可能潜在地阐明含有手性酶的生物体的高呼吸效率,并为提高燃料电池中的催化剂效率提供了一个新思路。
实验结果
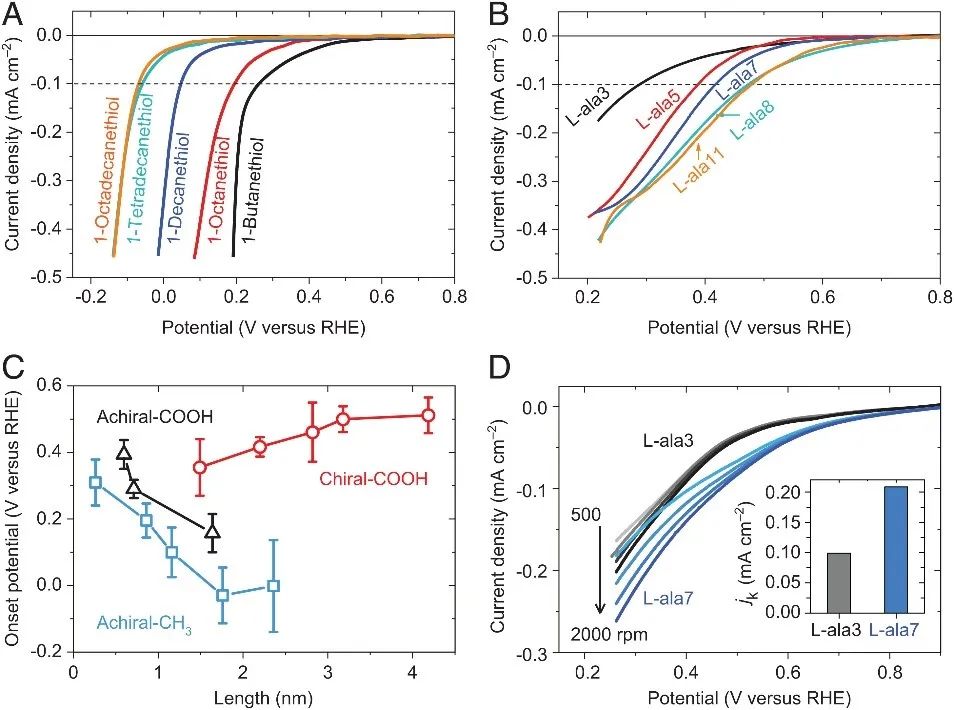
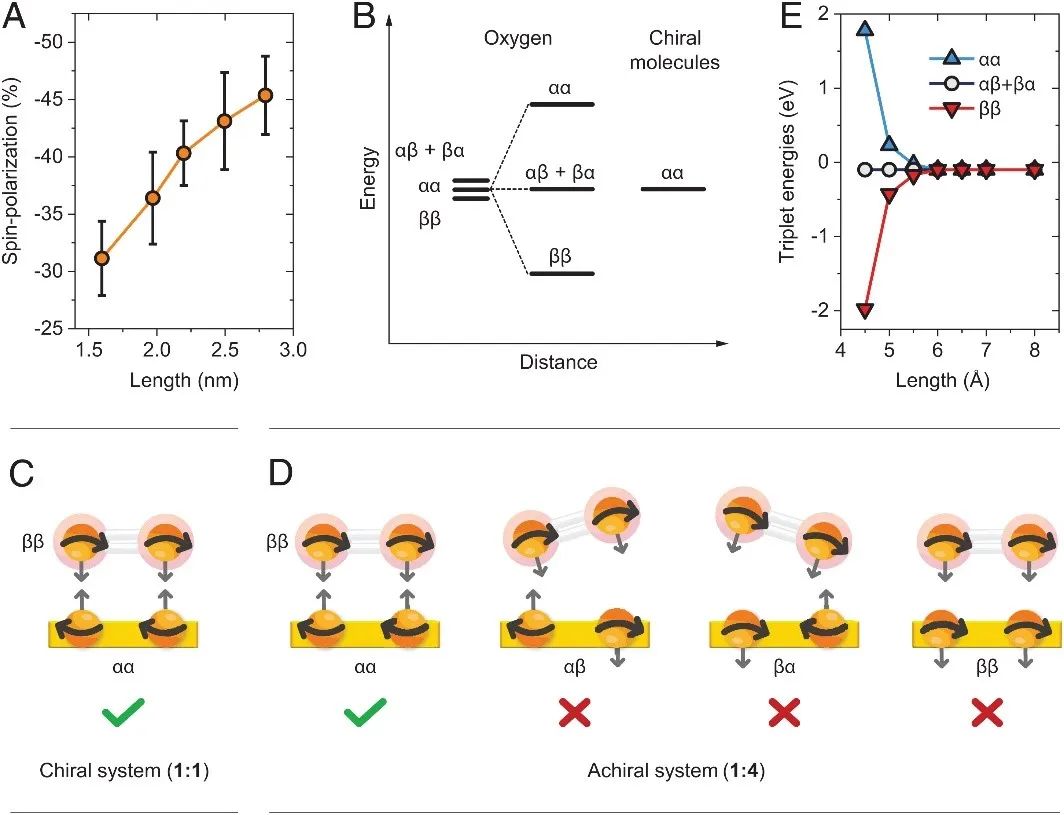
作者首先对比了手性分子和非手性分子修饰的工作电极对氧还原反应(ORR)的影响。图1A是实验的装置示意图,其中工作电极使用的是修饰了手性或非手性分子的100 nm厚的金膜电极,对电极为铂,参比电极是Ag/AgCl,电解质是O2或N2饱和的0.1 M KOH溶液。图1B是电化学测试实验结果,其中虚线是在N2饱和的电解液中测得的线性扫描伏安(LSV)曲线,可以看到在没有氧气的电解液中,无氧还原反应的发生。实线是O2饱和的电解液中测得的LSV曲线,可以看到修饰了手性分子L-半胱氨酸的电极表现出更正的起始电位,相较于修饰非手性分子3-巯基丙酸的电极,大约提前了0.17 V,表明修饰了手性分子的电极具有更强的ORR催化性能。 图1. (A)电化学测试装置的示意图,其中包括了修饰手性或非手性分子的自组装单层(SAM)的金工作电极。(B)当电极修饰手性分子(L-半胱氨酸,红线)或非手性分子(3-巯基丙酸,蓝线)时,在N2(虚线)和O2(实线)饱和的0.1 M KOH水溶液中测得的线性扫描伏安曲线。 随后,作者又探究了修饰物的分子长度对ORR的影响。图2A是工作电极修饰了不同长度的非手性烷烃的ORR测试结果,可以看到随着烷烃链的长度增加,ORR效果越差。相反,具有手性的分子越长,ORR效果越好(图2B)。从图2C统计的ORR起始电位和分子长度的关系也可以看到,非手性(Achiral)的分子越长起始电位越负,而手性(Chiral)分子越长起始电位越正。此外,作者还在旋转圆盘电极上重复了实验,以减小扩散控制带来的影响。可以看到在相同的转速下,修饰长链手性分子测得的电流密度总比短链的要高,这是因为长链的手性分子相较于短链具有更强的手性诱导自旋选择性(CISS)效应(图4A)。 图2. 非手性(A)和手性(B)分子长度对ORR的影响。(C) ORR起始电位和分子长度的关系。(D)旋转圆盘电极上测得的ORR极化曲线。 虽然从以上实验结果来看,手性分子修饰电极的ORR效果确实比非手性分子的好,但这种ORR差别到底是来源于手性,还是来源于这两种物质的自身性质的不同?用两种结构不同的分子修饰电极来对比ORR的催化活性似乎说服力不够。因此接下来作者比较了具有手性和非手性的同种金属纳米粒子(金和铂)对ORR的影响。作者将L-半胱氨酸修饰在金属纳米粒子上使其具有手性,将DL-半胱氨酸(内外消旋体)修饰在金属纳米粒子上作为非手性对照。 结果表明,手性纳米粒子比非手性纳米粒子修饰的电极在ORR中具有更正的起始电位,如图3A所示。此外手性铂纳米颗粒的ORR催化效果甚至比商用的铂碳催化剂效果还好(图3B中的红线)。图3C是一个统计图,表明手性铂纳米粒子具有更正的起始电位和半波电位以及更大的电流密度,此外它还具有更高的质量活性和位点活性(图3D)。 图3 (A)用手性(红线)和非手性(蓝线)金纳米颗粒在O2饱和的0.1 M KOH中测得的静态ORR极化曲线。(B)商用Pt/C(黑线)、非手性铂纳米颗粒(蓝线)、手性铂纳米颗粒(红线)在旋转圆盘电极上测得的ORR极化曲线。(C, D)三种铂颗粒的ORR性能及活性对比。 最后,作者阐述了手性增强氧还原的机理。首先作者研究了手性分子的自旋极化和分子长度的关系,手性分子越长,其极化电子的能力越强(图4A)。当氧接近手性体系时,它的两个非成对电子会发生自旋态分裂(图4B、E),且会与手性体系中的电子发生自旋交换作用而稳定为ββ。对于手性体系,从手性薄膜转移出的电子只有一种自旋态配置(αα),可以有效地与氧气的ββ自旋配置作用,这一过程有效地降低了反应势垒(图4C)。对于非手性分子,非手性分子层中转移出的电子有4种自旋态配置,包括αα、ββ、αβ和βα,其中只有αα能使电子有效地转移到氧,因此反应概率只有四分之一(图4D)。这就解释了手性为什么能增强ORR。 图4 (A)自旋极化和手性寡肽长度的关系。(B)三线态氧在与手性分子上的自旋极化电子相互作用时的自旋态分裂。电子在手性(C)和非手性(D)体系中可能的自旋态。(E)计算出的氧上的三重态能级是手性分子与氧之间距离的函数。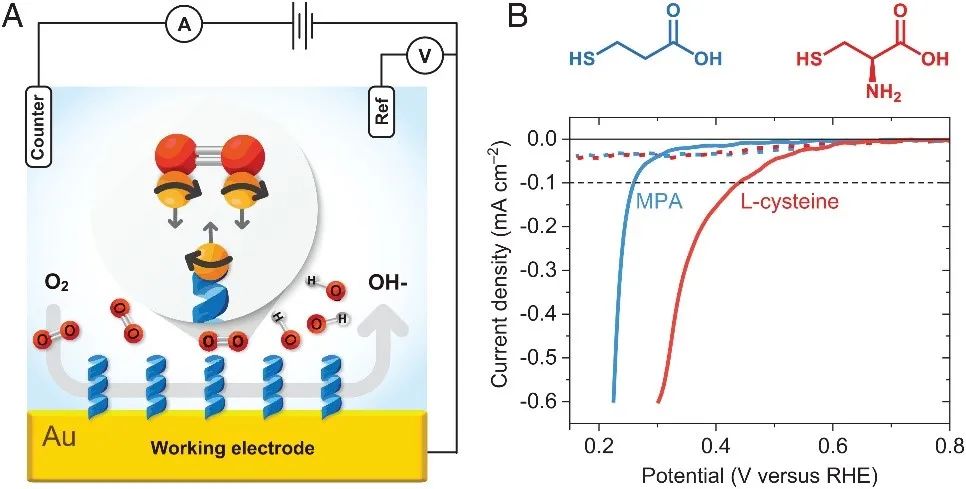



 地址:广州市黄埔区揽月路3号国际企业孵化器F座310
地址:广州市黄埔区揽月路3号国际企业孵化器F座310 电话:18922204815
电话:18922204815  传真:020-84418344
传真:020-84418344 邮箱:mzzhang@chiral-se.com
邮箱:mzzhang@chiral-se.com

