前沿 |【Coord.Chem.Rev.】仿生手性纳米酶:合成策略、分类、生物效应和生物医学应用

Coordination Chemistry Reviews ( IF 20.6 )

1. 介绍
手性源于分子中原子的空间排列,是分子识别和催化的基础。它在制药、农业和生物过程中起着重要作用。显然,生物体内的大多数基本分子都表现出手性,并在生理过程中优先采用单对映体形式。例如,氨基酸以左旋(L)异构体存在,糖以右旋(D)异构体存在,蛋白质的α-螺旋以D-异构体存在。这种偏好使得这些手性生物分子和给药的手性药物之间的精确对映体识别成为可能,这些药物必须匹配构型才能有效。不匹配或相反的对映体可能是无活性的或有毒的。
目前临床上常用的药物中,高达50%是含多巴胺(DOPA)、紫杉醇、青蒿素、萘普生的手性药物。在农业中,使用了大量的手性昆虫信息素和杀虫剂,其中L型和D型具有不同的活性,如除草或诱变作用。由于其独特的立体选择性和生物相容性,手性分子被广泛应用于不对称合成、手性催化、手性识别、对映体分离等领域,特别是在生物医学领域。
在过去的十年中,大量的生物医学研究利用纳米材料的手性来开发基于其对映体选择性的各种疾病的治疗方法。先前的研究表明,制备的纳米颗粒(NPs)固有地表现出手性;然而,这些NPs通常是外消旋的,不表现手性信号。考虑到当前纳米技术分离对映体的固有挑战,通过合成纳米材料的一般方法直接获得单手性对映体是不可行的。1998年之前,Whetten等人在l-谷胱甘肽(GSH)的辅助下成功合成了手性金纳米团簇(Au NCs),为手性纳米材料的制备奠定了基础。随后,利用手性分子制备了Au和Ag的NCs等手性纳米材料,通过影响NPs的整体构型来产生手性。
迄今为止,已经建立了各种合成方法来制造手性纳米材料。这些方法包括利用不同的手性分子作为还原剂和稳定剂,如手性谷胱甘肽、手性组蛋白(His)、手性半胱氨酸(Cys)和具有不同螺旋结构的DNA。此外,圆偏振光(CPL)作为辅助手段促进了手性纳米材料的制备,并探索了手性分子的碳化制备具有本征手性的纳米材料。
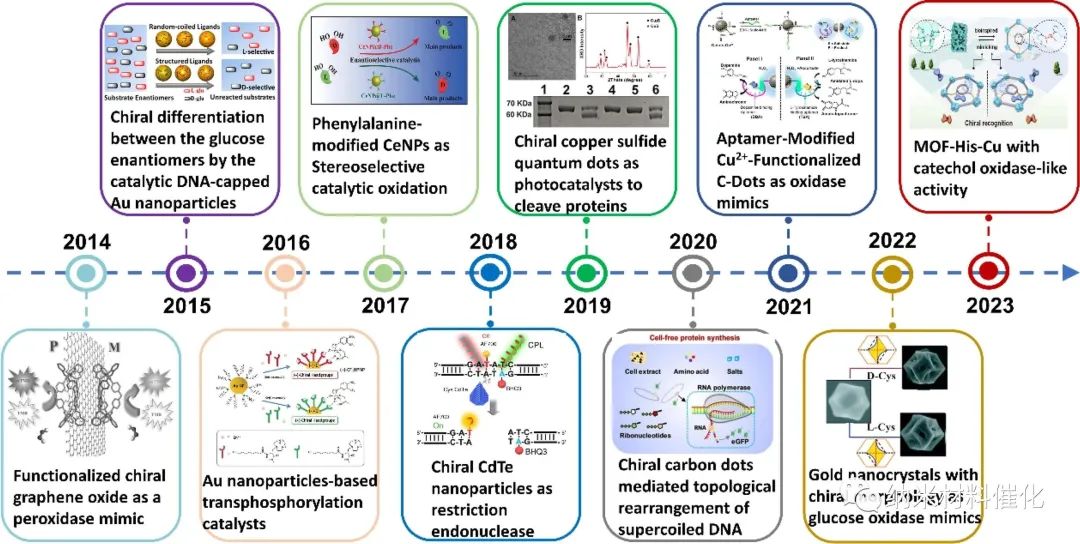
图1:简要介绍了手性纳米酶在过去十年中的发展。
由于无机金属氧化物纳米材料被发现具有过氧化物酶(POD)样活性,研究人员发现某些无机纳米材料具有固有的天然酶模拟活性,称为纳米酶。例如,Ge等人发现基于Pd的NPs表现出类似POD的活性,并具有促进抗坏血酸氧化的能力。此外,最近的研究表明,MoS2纳米片具有多种酶模拟活性,包括POD、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)。这些特性使MoS2纳米酶能够形成自级联催化反应,从而有效地防止氧化。已有大量研究阐明了无机材料固有的酶模拟行为,理论计算表明,纳米材料可以降低催化反应的活化能,促进电子转移,从而发挥催化作用。
此外,大量研究表明,纳米材料的性能与其手性等因素有着错综复杂的关系。纳米酶克服了天然酶的可回收性、活性可控、制备成本低等缺点。然而,缺乏立体选择性仍然是制约纳米酶进一步发展的一个重要因素。因此,鉴于纳米酶相对于天然酶的独特优势和手性的立体选择性,将手性材料的立体选择性与纳米酶的生物酶活性相结合应该是一个有吸引力的策略。手性将赋予纳米酶更多潜在的生物学应用。尽管如此,值得注意的是,对手性纳米酶的全面综述仍然缺乏。因此,系统地综述了手性纳米酶的相关研究进展。
这篇综述精心整理了手性纳米酶的进展,跨越了它们在过去十年的发现、发展和应用的时间线(图1)。首先,提出了制备手性纳米酶的合成策略。基于大量证据,分析揭示了手性的起源与制造这些纳米酶所使用的特定合成技术之间的强烈相关性。因此,强调了合成方法在形成这些纳米结构的手性方面的关键作用。随后,根据其催化活性对手性纳米酶进行了分类。与纳米酶类似,人们发现手性纳米酶具有一系列酶模拟活性,如POD、CAT、氧化酶和裂解酶活性。这种分类使得能够更深入地了解手性纳米酶所表现出的多种酶特性。此外,描述了手性纳米酶的生物医学应用,包括传感、成像和生物医学治疗。此外,还将讨论手性纳米酶的生物学效应,包括手性纳米酶与生物分子的相互作用、细胞识别和内化、NPs在细胞内生物过程中的参与以及细胞毒性。最后,对手性纳米酶研究面临的挑战和前景进行了展望。
2. 手性纳米酶的设计与合成
首先介绍了构建不同类型手性纳米酶的合成策略,包括基于固有手性的纳米酶和基于手性分子的纳米酶。手性纳米酶的合成方法对其手性有重要影响。配体选择、反应持续时间和外部能量干预的变化有可能产生不同的纳米材料形态、电化学构型和立体选择性。因此,研究手性纳米酶的合成方法对推进手性纳米酶的开发和应用具有重要意义。
同时,值得注意的是,虽然我们在这篇综述中讨论的某些材料可能没有明确报道为纳米酶,但已经将它们包括在这篇综述的讨论中,这种包涵扩展到具有芬顿样活性的材料和利用单个对映体合成的手性纳米酶。虽然通常对纳米材料的手性进行成对评价,但存在仅对一种对映体进行检查的特定情况。因此,我们的评论线程不仅包括成对的手性纳米材料,还包括单个对映体。
3. 手性纳米酶的类型和催化方式
酶参与许多关键的过程,如代谢、能量转换和营养吸收,在生物体内。在生物工程领域,酶的重组表达、酶的分子设计、酶的分子修饰等方面都取得了重大进展。因此,生物酶得到了越来越多的应用。然而,必须承认,尽管取得了这些进步,酶的缺陷仍然是一个固有的挑战。具有内在酶模拟活性的NPs于2007年首次报道,被称为纳米酶。纳米酶因其稳定性、成本效益、对恶劣环境的稳健性以及易于制备和保存而成为生物酶的可行替代品。因此,人们努力寻找具有酶模拟特性的替代材料;另一方面,许多研究旨在通过战略性修饰来增加纳米材料的酶模拟活性。
最近的研究发现,Pd NCs表现出面依赖性的类似氧化酶的催化活性。具体而言,多面钯立方体的酶模拟特性比(11 11)多面钯八面体具有更高的催化活性。这些特性可以在有效的抗菌剂中实现。此外,还发现凹形结构的Pd-NCs比平面Pd-NCs具有更有效的催化活性。然而,人工纳米酶在生物医学应用中仍然表现出一定的局限性。像其他纳米酶一样,手性纳米酶本质上表现出一系列的酶模拟活性,包括POD、氧化酶、CAT和SOD。这些性质为手性纳米酶的应用打开了新的大门。
4. 手性纳米酶的应用
本节综述了手性纳米酶在生物医学领域的研究进展。作为手性纳米酶,还将讨论它们在其他领域的潜在应用,借鉴手性纳米材料的类似应用报道。
5. 手性纳米酶的生物学效应
一对手性药物对映体由于具有镜像结构的生物系统与对映体具有不同的亲和能力和作用位点,其疗效往往不一致。药物的作用将有三种可能,包括有效、无效,甚至有毒。这些差异也可以通过检查药物的药效学和药代动力学来研究。手性纳米酶也保持类似的效果。对映体的生物效应可以是相同的,也可以是完全不同的,我们称之为手性纳米酶的立体选择性生物效应。在本节中,回顾了手性纳米酶的生物学效应,以探索手性与生物系统之间的关系(图19A)。
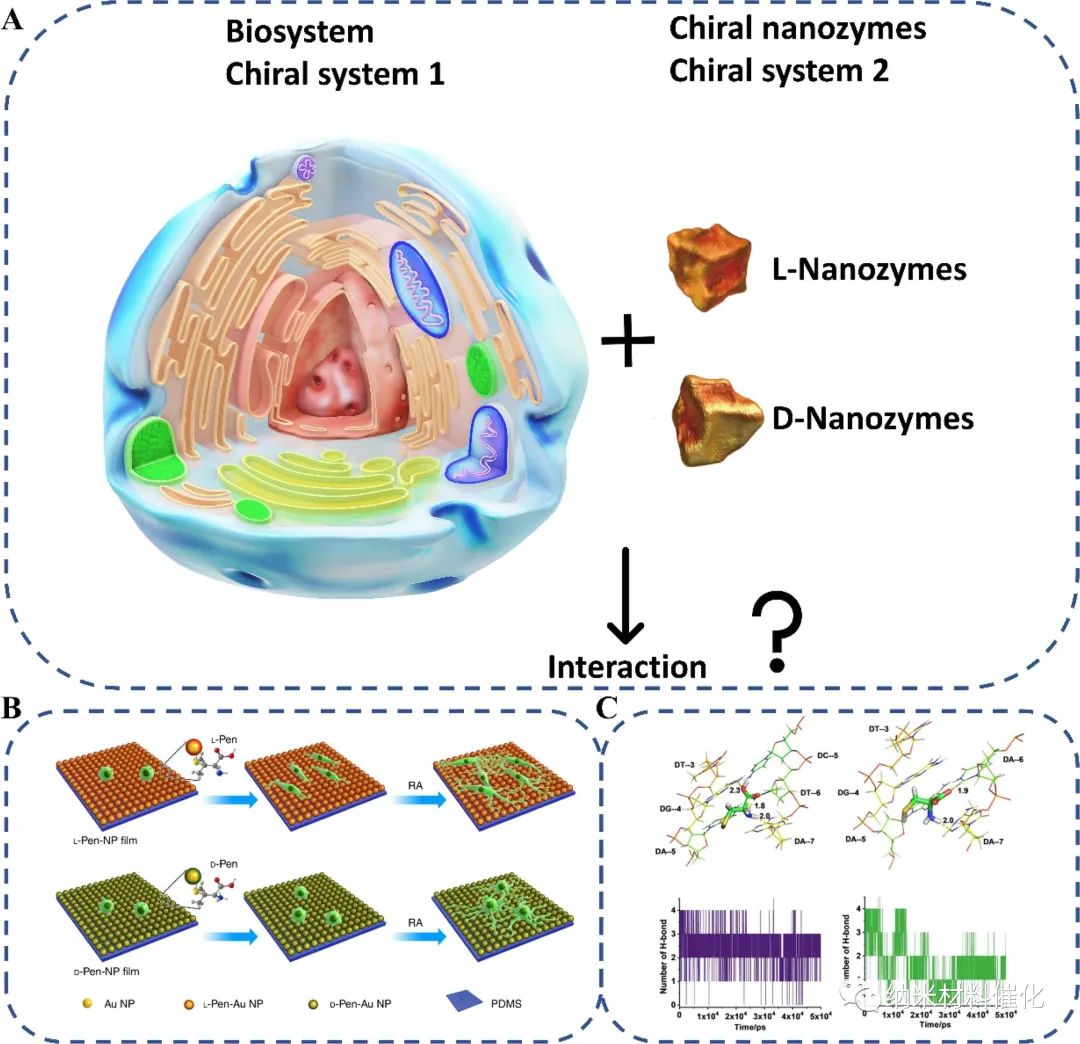
图19:手性纳米酶的生物学效应。(A)当两个手性体系相遇时会发生什么?(B)纤维连接蛋白与手性NP膜立体特异性相互作用调控NG108-15细胞粘附示意图。(C) dsDNA与手性Cys相互作用的分子动力学模拟。
6. 挑战与前景
手性是分子的一种基本性质,对分子在各种化学和生物过程中的立体选择相互作用有着深远的影响。天然酶作为一种重要的催化剂,具有催化活性和手性选择性。近年来,研究人员成功地将这些特性结合在了手性纳米酶的开发中,这些纳米酶既具有模拟酶的催化能力,又具有基于手性的对映体区分能力。这些纳米结构不仅弥补了生物催化和合成催化之间的差距,而且为设计具有定制性能的新材料开辟了道路。手性纳米酶的相关研究尚未完全展开,但它们是有潜力取代天然生物酶的纳米材料。手性纳米酶将为设计新型催化纳米材料提供令人兴奋的机会,并在不对称合成和手性分子识别等领域推进应用。根据目前报道的研究结果,我们提出了手性纳米酶面临的挑战和展望。
(1)合成策略
手性纳米酶的合理设计、精确的结构控制和表面化学性质对调节其立体选择性、催化性能和其他物理化学性质至关重要。人们设计了各种方法来制造手性材料,包括将手性分子吸附到纳米材料上或通过切割晶体暴露手性扭结纳米材料。与其他纳米材料一样,合成具有均匀形态、良好分散性和稳定性的手性纳米酶是主要的挑战。另一方面,通过构建手性纳米酶在纳米尺度上实现对手性的精确控制是另一个重大挑战。因此,需要进一步研究手性纳米酶的合理设计。
(2)生物医学应用
手性纳米酶的生物医学应用在传感、成像、给药和多功能精密治疗等领域提供了巨大的机会。例如,利用底物特异性和聚集诱导的手性纳米酶的增强可以使非侵入性光学成像方式可视化体内的生物过程。此外,CPL近年来也被应用于手性纳米酶的研究中。由于CPL比普通光源包含和传递更丰富的信息,CPL与手性纳米酶的结合可以拓宽手性纳米酶在基因编辑、生物信息加密、生物信息存储等方面的应用领域。
(3)手性纳米酶与生物系统的立体特异性相互作用
手性纳米材料领域的一个重要限制是手性纳米酶与生物系统之间不一致的手性立体特异性相互作用。例如,d型His@COFs对d型DOPA具有高亲和力和DOPA氧化酶模拟活性,而l型CeNPs对d型DOPA也具有高亲和力和催化活性。这一现象阻碍了我们对手性纳米酶与生物系统之间相互作用机制的理解。同时,对手性纳米酶的研究有限,缺乏对手性纳米酶与生物系统相互作用机制的全面研究。人工智能(AI)在手性纳米酶中的应用有望提高其合成效率和可预测性。未来,人工智能可以用于研究手性纳米酶与生物系统之间的相互作用机制,从而为开发更合理、更高效的合成方法提供有价值的见解,用于临床应用。
由于生物屏障、微环境和组织结构的影响,手性纳米酶在体内的命运是多变而复杂的。为了克服这一挑战,更先进的原位分析方法被用于分析生物环境中纳米酶的原位性能。值得一提的是,基于同步辐射的分析方法在分析界面相互作用方面表现出了出色的能力。然而,必须注意的是,原位和时间分辨XAS分析需要样品中目标元素的高含量,以确保令人满意的信噪比。因此,为了克服单个方法的局限性,考虑多种分析技术的结合变得势在必行。这种方法使研究人员能够更系统、更深入地了解纳米材料与生物体之间相互作用的整个过程。
仿生手性纳米酶遵循大自然的智慧,为生物医学开辟了一条令人兴奋和充满希望的道路。本文旨在为手性纳米酶的发展提供思路,希望能引起研究人员对手性和纳米酶领域的更多关注。随着纳米技术的进步,我们期望将来会有更多的生物启发策略被用于设计和制造仿生纳米酶。


 地址:广州市黄埔区揽月路3号国际企业孵化器F座310
地址:广州市黄埔区揽月路3号国际企业孵化器F座310 电话:18922204815
电话:18922204815  传真:020-84418344
传真:020-84418344 邮箱:mzzhang@chiral-se.com
邮箱:mzzhang@chiral-se.com

